La imagen anterior no es un coche de juguete, corresponde al Vision Le Mans, una muestra de cómo ve Bugatti que serán los autos deportivos del futuro. Lo espectacular de este coche no es solo su diseño, sino que encierra tecnología muy avanzada, que se basa en la propulsión de iones. Pero, ¿sabes tú lo que es un ion? Aquí te lo explicamos.
¿Qué es un ion?
Un ion puede definirse como un átomo o molécula que ha ganado o perdido uno o más de sus electrones, lo que le proporciona una carga eléctrica positiva o negativa. Es decir, hay un desequilibrio en el número partículas cargadas positivamente (protones) y de partículas cargadas negativamente (electrones) en un elemento químico.
Los iones que se encuentran cargados positivamente se llaman cationes y los iones que se encuentran cargados negativamente, aniones. ¿Cuándo se carga un ion? Cuando un fenómeno produce una pérdida o ganancia de electrones, y número de electrones difiere del número de protones que se encuentran en el átomo o molécula.
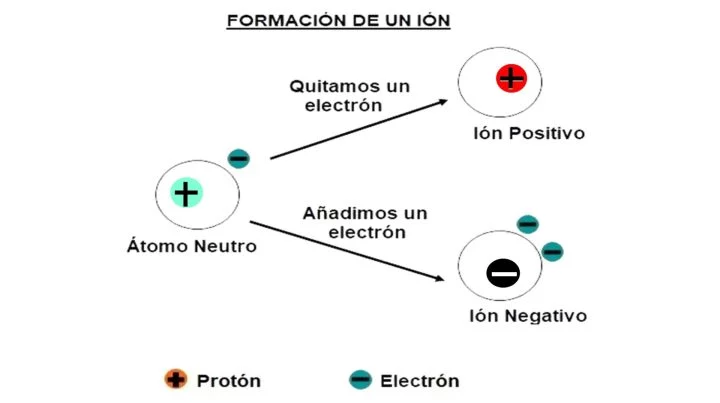
Si los cationes son los que tienen carga positiva, son aquellos que tienen menos electrones que protones (el electrón tiene carga negativa). Por el contrario, si los aniones son aquellos que tienen carga negativa, eso significa que tienen más electrones que protones. No obstante, esto solo hace referencia a los dos tipos de iones, pero en general hablaremos de los iones, y más cuando lo relacionamos con el mundo de los coches eléctricos.
¿Quién introdujo por primera vez el término Ion?
El químico y físico inglés Michael Faraday introdujo el término ion en 1834 al describir las moléculas químicas que viajan de un electrodo a otro en una solución acuosa. Y a pesar de que no pudo identificar las partículas que se mueven entre los electrodos, sí sabía que esas partículas se desplazaban hacia dichos electrodos.
Así, concluyó que la materia tenía que estar en constante movimiento al estar sometida a una corriente eléctrica.
Los cationes y los aniones
Los iones se agrupan en dos grandes categorías, llamadas:
Cationes
Los cationes son iones que poseen una carga positiva, debido a que el número de protones en la materia es mayor que el número de electrones. El catión se expresa en una fórmula mediante un indicador más pequeño que una línea de texto normal, el cual se coloca después de la fórmula, indica el número de la carga y un signo positivo; ejemplo: Ca 2+.
Aniones
Los iones que llevan una carga neta negativa son aniones y en ellos hay más electrones que protones. El número de neutrones no determina si un átomo o molécula es un anión. Al igual que los cationes, la carga de un anión se indica después de una fórmula química mediante un indicador más pequeño que una línea de texto normal que precede al signo menos. Ejemplo SO 4 2- que identifica al anión de ácido sulfúrico.
Los iones y las baterías de ion litio de los coches eléctricos
La existencia de los iones y la comprensión de su naturaleza es lo que nos ha permitido crear baterías con las que alimentar diferentes elementos electrónicos. Y por supuesto, esto tiene mucha relevancia cuando hablamos de los coches eléctricos. Y es que estos vehículos cuentan con las mismas baterías que otros elementos como patinetes eléctricos o nuestros propios móviles. E incluso tienen el mismo principio de funcionamiento, al ser baterías de ion-litio.
Todo sistema natural en nuestro entorno, como los sistemas eléctricos, tiende al equilibrio. En una batería, los iones de litio que hay en su interior se desplazan entre los dos polos, el ánodo y el cátodo, buscando equilibrar las cargas de estos. ¿Pero qué es lo que hace que se muevan así?
Cada material y cada elemento en la naturaleza tienen un comportamiento concreto, y cuando aprendemos cómo reacciona podemos sacar partido de él.
Para producir el efecto de la electricidad, lo que necesitamos es un electrón moviéndose. La base de una pila y de una batería está en que cuando no está en circuito cerrado los electrones están estables. Cuando se cierra el circuito, como ocurre al conectar cualquier cosa al ánodo y el cátodo de la batería, los electrones fluyen, y es el resultado es la electricidad.
Los electrones fluyen siempre del ánodo y el cátodo. ¿Y qué determina quién es quién? Depende de los materiales elegidos. Al igual que hay materiales más magnéticos que otros, hay materiales que tienen más tendencia a ceder electrones, y otros que tienen más tendencia a captarlos. De hecho, cuanto más tienda a ceder un material sus electrones, y más tienda otro material a captarlos, más tensión o voltaje tiene esa pila o batería.
En una batería de ion litio tenemos un ánodo de coque, este es un material derivado del carbono similar al grafito que tiene unas cualidades perfectas. Por un lado, tiene una gran tendencia a liberar electrones, y se comportará como un ánodo. Por otro lado, su estructura de capas permite que dentro de él se almacenen los iones, que es el tema que nos ocupa, y de los que vamos a hablar seguidamente.
Por otro lado, tenemos un cátodo de óxido de cobalto. De nuevo, su estructura de capas y su tendencia a captar electrones lo hacen ideal para ser un cátodo.
Sin embargo, para que pueda existir este flujo de electrones del ánodo al cátodo, también debe existir otro flujo. Esto es así porque como hemos dicho, los sistemas tienden al equilibrio. Así, como los electrones llevan carga negativa desde el ánodo hasta el cátodo, es necesario que también se pierda carga positiva desde el ánodo al cátodo. Si esto no ocurriera, aunque utilicemos materiales que tienen tendencia a liberar electrones y otros que tienen tendencia a captarlos, no seríamos capaces de producir un circuito eléctrico con electrones en movimiento que produzcan electricidad de forma mantenida, que es lo que conseguimos con una batería.
Pero es que resulta que justo eso es lo que sucede dentro de una pila y de una batería. Mientras los electrones viajan por el cable exterior de la pila, portando carga negativa, por el interior de la pila se desplaza una carga positiva.
Y aquí es donde entran los iones de litio. Necesitamos que en el interior de la pila haya un electrolito que permita pasar iones de carga positiva, pero no electrones con carga negativa. De esta forma, si no conectamos un cable externo, mantendremos nuestra pila cargada. Pero en cuanto conectamos el cable, la energía empieza a fluir.
El ser humano descubrió la gran utilidad de los iones de litio para este fin. De forma natural los átomos de litio tienen una tendencia brutal a liberar sus electrones y convertirse en iones. Así que son geniales para esto. Cuando conectamos un cable a nuestra batería, el litio que se encuentra en el ánodo, libera sus electrones, que van como locos a recorrer el cable hasta el cátodo. Y mientras tanto, los propios iones de litio se van hacia el cátodo por dentro de la batería para equilibrar las cargas.
Cuando en vez de utilizar la batería como fuente de energía, la conectamos a la red eléctrica, el proceso cambia. Se puede decir que en este caso, la red eléctrica es la que gobierna sobre nuestra batería, y sus cualidades hacen que el cátodo de la red eléctrica «robe» los electrones que se encuentran en el cátodo de nuestra batería. Esto es posible porque el equilibrio se mantiene en el bloque de la batería, pues el ánodo de la red eléctrica cede sus electrones al ánodo de la batería. Sin embargo, esto solo afecta a las cargas negativas, y solo es posible si también se equilibran las cargas positivas. No obstante, de nuevo son los iones de litio los que abandonan el cátodo de la batería (equilibrando positivas y negativas que allí había), y «suben» hacia el ánodo. Este proceso requiere de energía, y es por es por eso por lo que recargar una batería lleva tiempo. Cuando dotamos de electrones al ánodo de la batería por medio la red eléctrica, y atraemos hacia el ánodo de nuevo a todos los iones de litio, estamos recargando poco a poco la batería. Una vez que todos los iones de litio están en el ánodo, la batería está al 100%.
Así, la capacidad de una batería viene determinada por los iones de litio. Cuando pisamos el acelerador de un coche eléctrico, lo que estamos haciendo es sacar energía del paso de electrones y de iones de litio del ánodo al cátodo, cada uno por su camino. Cuando hemos pasado todos los iones de litio que tenemos en el ánodo al cátodo, ya no tenemos forma de sacar electricidad de ahí hasta que recarguemos la batería.
De aquí se deduce algo: más iones es igual a más capacidad de energía. Y de ahí que se trabaje en formas de condensar aun más la cantidad de litio de las baterías, o de utilizar otros materiales que tengan una función similar y nos permitan mover más energía en un tamaño más pequeño. Los electrolitos sólidos, por ejemplo, suponen un avance, pues además reducen los problemas de tener electrolitos líquidos a base de iones de litio que puede tener una fuga, generar gases y explotar en caso de cambios bruscos de temperatura o un accidente. En las baterías «sólidas» nos ahorramos esos problemas.













